Hallo kali ini kita akan kembali membahas tentang Pelajaran Sekolah yaitu Hukum Dasar Kimia : Lengkap Dengan Bunyi Hukum dan Rumus. Dalam mempelajari hukum dasar kimia, ada konsep yang menghubungkan antara suatu satuan dengan satuan kimia yang lainya, yang disebut dengan konsep mol.
Mol yaitu satuan yang dipakai untuk menyatakan jumlah partikel pada suatu zat. Konsep mol membantu dalam perhitungan kimia dan penentuan rumus pada kimia zat. Konsep mol, perhitungan kimia, dan penentuan rumus kimia didasari pada hukum-hukum dasar kimia, yaitu :
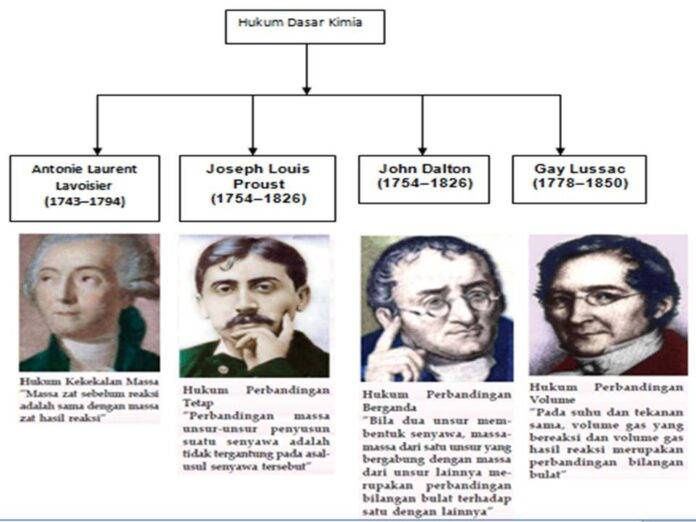
- hukum kekekalan massa
- hukum perbandingan tetap
- hukum perbandingan berganda
- hukum penggabungan volume
- hipotesis Avogadro.
Hukum Dasar Kimia
Hukum dasar kimia meliputi hukum kekekalan massa, hukum perbandingan tetap, hukum perbandingan berganda, hukum penggabungan volume dan juga hukum avogrado, berikut adalah penjelasan lengkap nya
Hukum kekekalan massa

Hukum kekekalan massa dikenal juga hukum Lomonosov-Lavoisier yang merupakan suatu hukum yang menyatakan massa dari sistem tertutup akan konstan walaupun terjadi berbagai macam proses di dalam sistem itu sendiri. Pernyataan yang umum dipakai guna menyatakan hukum kekekalan massa yaitu :
“Massa mampu berubah bentuk akan tetapi tidak bisa diciptakan ataupun dimusnahkan”
Suatu proses kimiawi dalam suatu sistem tertutup, massa dari reaktan harus sama dengan massa produk.
Hukum kekekalan massa dipakai secara luas seperti:
- kimia
- teknik kimia
- mekanika
- dinamika fluida
Berdasarkan relativitas spesial, kekekalan massa merupakan pernyataan dari kekekalan energi. Massa partikel yang tetap pada suatu sistem ekuivalen dengan energi momentum pusatnya. Pada beberapa peristiwa radiasi, dikatakan bahwasanya terlihat adanya perubahan massa menjadi energi. Hal ini terjadi saat suatu benda berubah menjadi energi kinetik/energi potensial dan juga sebaliknya.
Hukum Perbandingan Tetap

Dalam ilmu kimia, hukum perbandingan tetap atau umum dikenal dengan hukum Proust yang diambil dari nama kimiawan Perancis Joseph Proust yaitu hukum hukum yang menyatakan bahwa :
“Suatu senyawa kimia terdiri atas unsur-unsur dengan perbandingan massa yang selalu sama”
Dengan istilah lain, setiap sampel pada suatu senyawa mempunyai komposisi unsur yang tetap. Misalnya, air terdiri atas 8/9 massa oksigen dan 1/9 massa hidrogen. Bersama dengan hukum perbandingan berganda (hukum Dalton), hukum perbandingan tetap yaitu hukum dasar stoikiometri.
Hukum Perbandingan Berganda

Dalam ilu kimia, hukum perbandingan berganda yaitu salah satu hukum dasar stoikiometri. Hukum ini juga terkadang disebut hukum Dalton yang diambil dari nama kimiawan Inggris John Dalton, tetapi biasanya hukum Dalton merujuk kepada hukum tekanan parsial. Hukum ini menyatakan bahwa :
“Jika dua unsur bereaksi kemudian membentuk dua atau lebih senyawa, maka perbandingan berat salah satu unsur yang bereaksi dengan berat tertentu dari unsur yang lain pada kedua senyawa itu selalu merupakan perbandingan bilangan bulat sederhana”
Contohnya karbon bereaksi dengan oksigen dan membentuk karbondioksida (CO2) dan karbonmonoksida (CO).
Jika jumlah karbon yang bereaksi pada masing-masing 1 gram, maka diamati bahwa pada karbonmonoksida yang terbentuk akan ada 1,33 gram oksigen dan 2,67 gram oksigen pada karbondioksida.
John Dalton pertama kali mengemukakan pengamatan ini sejak tahun 1803. Beberapa tahun sebelumnya, kimiawan Perancis sudah mengemukakan hukum perbandingan tetap. Dalton merumuskan hukum ini berdasarkan pengamatan kepada nilai-nilai perbandingan Proust. Kedua hukum ini merupakan penemuan yang amat penting untuk menjelaskan bagaimana senyawa terbentuk dari atom-atom. Kemudian pada tahun yang sama, Dalton mengajukan teori atom yang menjadi dasar dari konsep rumus kimia dalam senyawa
Hukum Penggabungan Volume

Hukum penggabungan volume menyatakan bahwa :
“Saat gas bereaksi bersama-sama menjadi gas lain, dan semua volume diukur pada suhu dan tekanan yang sama”
Maka rasio antara volume gas reaktan dengan produk bisa dinyatakan dalam bilangan bulat yang sederhana. Hukum penggabungan volume gas dipublikasikan Joseph Louis Gay-Lussac tahun 1808.