Pengertian Kesetimbangan Kimia lengkap Ciri-Ciri, Hingga Rumus dan Contoh Soal, Berikut ini pelajaran Sekolah akan memberikan materi tentang Kesetimbangan Kimia lengkap dari pengertian, rumus hingga contoh soal dan penjelasannya.
Pelajaran sekolah ini dapat menjadi referensi dalam pembelajaran di sekolah maupun di rumah. Dengan begitu simak penjelasannya berikut ini.
Pengertian Kesetimbangan Kimia
Seperti yang dijelaskan di atas bahwa pengertian kesetimbangan kimia yaitu keadaan reaksi bolak-balik dimana laju reaksi reaktan dan produk sama dan konsentrasi keduanya tetap. Kesetimbangan kimia cuma terjadi pada reaksi bolak-balik dimana laju terbentuknya reaktan sama dengan laju terbentuknya produk. Reaksi akan terjadi terus menerus secara mikroskopis jadi disebut kesetimbangan dinamis.
Ciri-ciri keadaan setimbang
- Terjadi dalam wadah tertutup, pada suhu dan tekanan tetap
- Laju reaksi ke reaktan sama dengan laju reaksi ke produk.
- Reaksinya berlangsung terus-menerus (dinamis) dalam dua arah yang berlawanan.
- Terjadi secara mikroskopis pada tingkat partikel zat.
- Konsentrasi produk dan reaktan tetap.
Pergeseran kesetimbangan kimia
Ada beberapa faktor yang mempengaruhi pergeseran kesetimbangan kimi, diantaranya konsentrasi zat, temperatur, dan tekanan atau volume. Selengkapnya dapat kalian perhatikan pada penjelasan dibawah ini.
Pengaruh konsentrasi zat terhadap kesetimbangan kimia
apabila konsentrasi salah satu zat ditambah, jadi reaksi kesetimbangan akan bergeser dari arah (menjauhi) zat yang ditambah konsentrasinya.
apabila konsentrasi salah satu zat dikurangi, jadi reaksi kesetimbangan akan bergeser ke arah zat dikurangi konsentrasinya.
Contoh :
Pada persamaan reaksi berikut.
N2(g)+ 3H2(g) <==> 2NH3(g) H = -92 kJ
jika konsentrasi N2 ditambah jadi reaksi kesetimbangan akan bergeser ke kanan, karena jika konsentrasi zat ditambah maka reaksi kesetimbangan akan bergeser dari arah yang ditambah konsentrasinya.
jika konsentrasi N2 dikurangi maka reaksi kesetimbangan akan bergeser ke kiri, karena jika konsentrasi zat dikurangi maka reaksi kesetimbangan akan bergeser ke arah yang ditambah konsentrasinya.
Pengaruh tekanan dan volume terhadap kesetimbangan kimia
jika tekanan pada sistem ditambah atau volume diperkecil maka reaksi kesetimbangan akan bergeser ke arah jumlah molekul yang lebih kecil.
jika tekanan pada sistem diperkecil atau volume ditambah maka reaksi kesetimbangan akan bergeser ke arah jumlah molekul yang lebih besar.
“tekanan dan volume berbanding terbalik”
Contoh : Pada persamaan reaksi berikut
N2(g)+ 3H2(g) <==> 2NH3(g) H = -92 kJ
Jumlah mol reaktan = 1 + 3 = 4
Jumlah mol produk = 2
jika tekanan pada sistem ditambah jadi reaksi kesetimbangan akan bergeser ke kanan, karena apabila tekanan ditambah maka reaksi kesetimbangan akan bergeser ke arah jumlah molekul yang lebih kecil yaitu 2.
jika volume pada sistem dikurangi jadi reaksi kesetimbangan akan bergeser ke kanan, karena apabila volume sistem dikurangi maka reaksi kesetimbangan akan bergeser ke arah jumlah molekul yang lebih kecil yaitu 2.
jika tekanan pada sistem dikurangi jadi reaksi kesetimbangan akan bergeser ke kiri, karena apabila tekanan ditambah. Jadi, reaksi kesetimbangan akan bergeser ke arah jumlah molekul yang lebih besar yaitui 4.
jika volume pada sistem ditambah jadi reaksi kesetimbangan akan bergeser ke kiri, karena apabila volume sistem ditambah. Jadi, reaksi kesetimbangan akan bergeser ke arah jumlah molekul yang lebih besar yatui 4.
Pengaruh temperatur terhadap kesetimbangan kimia
Jika temperatur sistem dinaikkan maka reaksi kesetimbangan bergeser ke arah reaksi yang membutuhkan kalor atau endoterm.
jika temperatur sistem dikurangi maka rekasi kesetimbangan akan bergeser ke arah zat yang melepaskan kalor atau eksoterm.
Contoh :
Pada persamaan reaksi
[A] + [B] <==> [C] H = -X
[C] adalah reaksi eksoterm (melepaskan kalor) dan [A] + [B] adalah reaksi endoterm (membutuhkan kalor).
jika temperatur dinaikkan maka reaksi kesetimbangan akan bergeser ke kiri dikarenakan apabila temperatur sistem dinaikkan maka reaksi kesetimbangan akan bergeser ke arah reaksi yang membutuhkan kalor atau endoterm.
jika temperatur diturunkan maka reaksi kesetimbangan akan bergeser ke kanan dikarenakan apabila temperatur sistem dinaikkan maka reaksi kesetimbangan akan bergeser ke arah reaksi yang melepaskan kalor eksoterm.
Hukum kesetimbangan kimia
Hukum kesetimbangan kimia atau tetapan kesetimbangan yaitu perbandingan dari hasil konsentrasi produk berpangkat koefisiennya masing-masing dengan konsentrasi reaktat berpangkat koefisiannya masing-masing. Tetapan kesetimbangan biasanya disimbolkan dengan “K” ataupun “Kc”
Rumus umum kesetimbangan kimia
Persamaan ataupun rumus untuk kesetimbangan kimia, dapat kalian lihat pada contoh dibawah ini:
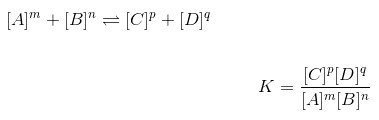
Kesetimbangan heterogen
bentuk zat-zat yang terlibat dalam reaksi pada kesetimbangan heterogen ini tidak sama, maka yang diambil untuk menentukan tetapan kesetimbangan yaitu konsentrasi zat yang tetapan kesetimbangannya dipengaruhi yaitu larutan dan gas.
Kesetimbangan homogen
Pada kesetimbangan heterogen ini bantuk zat-zat yang terlibat pada reaksi sama, jadi seluruh konsentrasi zat dipakai untuk menentukan tetapan kesetimbangan. Tapi yang perlu kalian ingat, bahwa yang dipengaruhi dalam tetapan kesetimbangan hanya bentuk gas dan larutan saja.
Contoh soal
Diketahui bahwa suatu reaksi kesetimbangan
2A + B <==> A2B
Pada kondisi awal di dalam bejana 2 liter terdapat 2 mol A dan 2 mol B. apabila dalam kesetimbangan 0,5 mol A, jadi berapakah tetapan kesetimbangannya ?
Penyelesaian:
Dari penyataan diatas dapat ditentukan jumlah mol sebagai berikut:
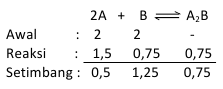
Maka:
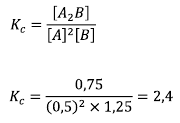
Volume dalam permasalahan tersebut berpengaruh karena akan saling menghilangkan
Tetapan kesetimbangan parsial
Tetapan kesetimbangan parsial ialah perbandingan dari hasil kali tekanan pasrsial produk berpangkat kofisiennya masing-masing dengan tekanan pasrsial reaktan berpangkat kofisiennya masing-masing. Tetapan kestimbangan parsial disimbolkan dengan “Kp”.
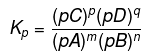
Keterangan:
P = tekanan parsial
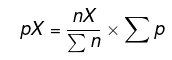
Keterangan:
pX = tekanan parsial yang akan dicari.
nX = mol dari zat yang akan dicari tekanan parsialnya.
En = total mol sistem.
Ep = total tekanan parsial sistem.
Contoh soal:
Sebanyak 6 mol NH3 dipanaskan hingga menjadi N2 dan H2. Saat kesetimbangan tercapai tersisa 2 mol NH3 . apabila tekanan total campuran gas adalah 10 atm maka tentukanlah harga Kpnya !
Penyelesaian:
Dari permasalahan diatas kita dapat menemukan data sebagai berikut:
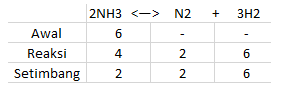
Total mol dalam sisitem:
![]()
Mencari tekanan persial pada tiap zat dengan persamaan:
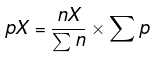
Sehingga diperoleh pBH3 = 2 atm, pN2 = 2 atm, dan pH2 = 6atm
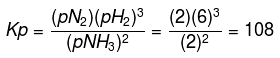
Hubungan Kesetimbangan Tekanan Parsial Dengan Tetapan Kesetimbangan
Hubungan tersebut dapat dinyatakan dengan persamaan sebagai berikut:
![]()
Keterangan:
R = kostanta gas
T = Suhu
p,q,m, dan n = kofisien dari zat yang bereaksi.
Derajat disosiasi
Derajat disosiasi yaitu nilai yang pakai untuk mengetahui berapa bagian zat yang terdisosiasi. Persamaan derajat disosiasi yaitu:
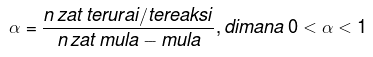
Arti tetapan kesetimbangan
Tetapan kesetimbangan bisa digunakan untuk beberapa fungsi, diantaranya adalah:
- Memberi petunjuk tentang posisi kesetimbangan
- Meramalkan arah reaksi
Itulah penjelasan lengkap dari Kesetimbangan Kimia lengkap dari rumus hingga contoh soal, Semoga bisa bermanfaat dan membantu anda.

